

Canlı ve cansız olan her şeyde kinetik, ışık, potansiyel, ısı ve kimyasal gibi farklı enerji türlerini görmek mümkündür. Doğada sürekli bu enerjiler arasındaki dönüşümleri gözlemler ve yararlanırız. Enerji, fizik bilim dalı içerisinde “iş yapabilme yeteneği” olarak tanımlanır. Burada, biyolojik bir işe örnek verirsek, nefes almak bir iştir. Farkında olarak yaşadığımız ya da olmayarak yaşadığımız aklınıza gelebilecek tüm süreçler enerji harcanarak gerçekleşir.
Durumlara göre kullanılan enerji türü değişir. En küçük birimimiz olan hücrelerde canlılığını devam ettirmek ve yaşamsal süreçler için sürekli enerjiyi dönüştürür ve harcar. Hücrelerimizin seçtiği enerji türü ise kimyasal enerjidir. Birçok enerji çeşidi bulunmasına rağmen hücreler neden kimyasal enerjiyi kullanmayı tercih etmiştir? Hatta bir bitki hücresi ışık enerjisini direkt kullanmak yerine kimyasal enerjiye çevirir ve fotosentez gerçekleştirir. Bu soruya cevap vermek için enerji çeşitliliği hakkında düşünmek faydalı olabilir, yani neden farklı enerji çeşitleri var?
Enerji farklı sistemler içerisinde termodinamik yasalarına göre kullanılır. Sistemdeki enerjinin iş yapabilmesi önemlidir ve koşullara uygun bir formdaki enerji daha elverişli olacaktır. Vücutta gerçekleşen metabolik faaliyetler hücre içerisinde gerçekleşmektedir. Hücreler içerisinde ısı enerjisi kullanılmaz çünkü ısının iş yapabilmesi için farklı sıcaklıkta bir başka alana veya nesneye geçiş yapması gerekir. Hücreler ise “izotermal sistemler” olarak tanımlanır yani sıcaklığın sabit tutulduğu sistemlerdir. Öyleyse hücre için sabit sıcaklıkta iş yapabilecek başka bir enerji çeşidine ihtiyaç vardır. Işık enerjisi de benzer şekilde elektronları hızlı şekilde uyarır ve yüksek enerji çıkışına neden olur, bu enerjinin dengeli bir hale gelmesi ve korunması daha zordur. Hücrelerimiz için yüksek enerjiyi kendi ortamında saklayabileceği en ideal enerji kimyasal enerjidir.
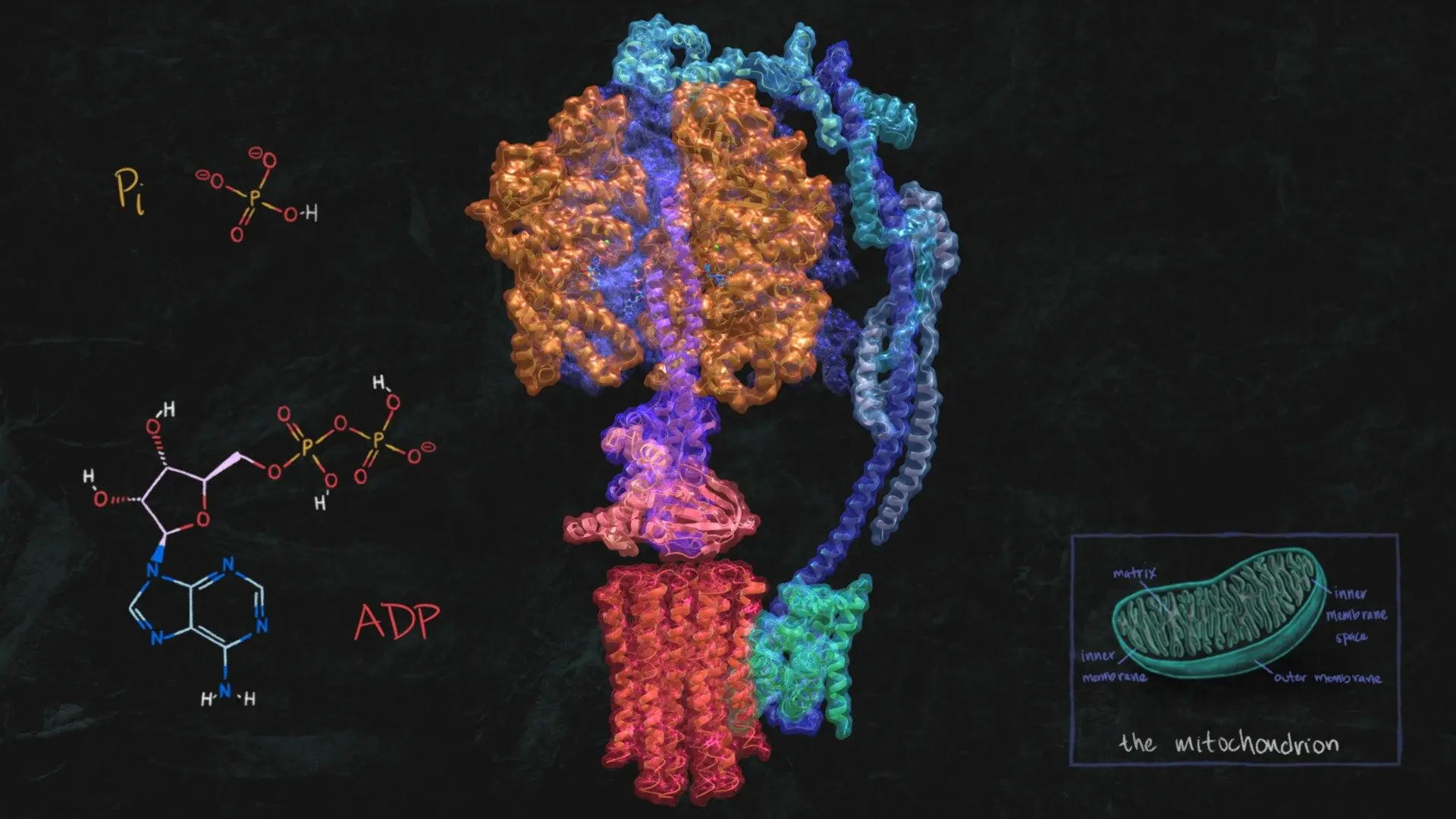
Kimyasal enerji, vücudumuzda bulunan en küçük yapılı moleküllerden büyük yapılı moleküllere kadar bileşikleri oluşturan atomlar arası kimyasal bağlarda depolanan enerjidir. Besin yolu ile aldığımız kimyasal enerji vücudumuzda ısı veya mekanik enerjiye dönüştürülür. Bu enerji ATP (Adenozin trifosfat) molekülünde depolanır ve bu molekül, hücrelerimizin kimyasal enerji kaynağıdır. Lise yıllarından hatırlarsanız ATP molekülünü hücrenin “enerji para birimi” olarak öğrenmiştik. Vücudumuzda binlerce farklı molekül bulunur. Proteinler, karbonhidratlar, yağlar ve türevlerini örnek olarak düşünebiliriz. Peki enerji birimi olarak neden en çok ATP kullanılır?
ATP molekülü, yüksek enerjiye sahip bir moleküldür. İçeriğindeki bağlar ve bileşiklerin konumları molekülün yüksek enerjili olmasını sağlar. Bir molekülün yüksek enerjili olması, içeriğinde bulunan bağlar kırıldığında yüksek enerjinin ortaya çıkmasından kaynaklıdır. ATP (Adenozin trifosfat) bir tane adenin bazı, bir riboz şekeri ve üç tane bağlı fosfattan oluşur. Yüksek enerji, fosfat bağlarından salınır. Fosfat molekülleri negatif yüke sahiptir. Negatif yükler birbirini iteceğinden bir arada durmaları oldukça zordur. Dolayısıyla fosfatların birbirlerinden ayrılma istekleri daha yüksektir.
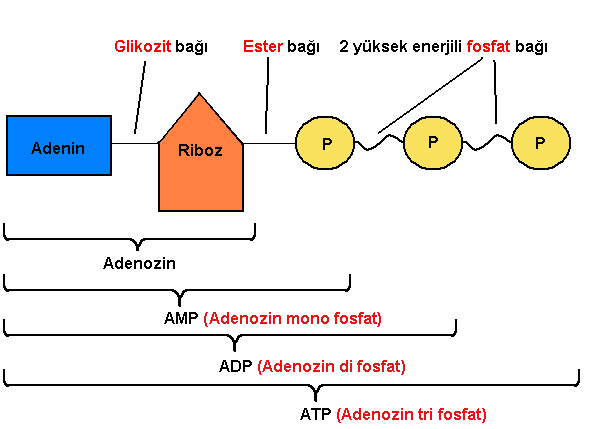
Bir molekülden enerji açığa çıkması için parçalanması gerekir. Fosfatlar arasında bulunan bağlar küçük bir müdahale ile kolayca kırılabilir. Bu kırılma sırasında neredeyse hiç enerji harcanmaz ancak sonucunda büyük bir enerji üretilir. Bu şekilde enerji açığa çıkan tepkimelere egzotermik tepkimeler denir.
Fosfat bağlarının kırılması sırasında birçok olay gerçekleşir. Sonda bulunan bir fosfat ayrıldığında her yönden su molekülleri ile çevrilir ve proton değişimleri meydana gelir. Sistemdeki bu küçük değişimler büyük enerjinin oluşmasına sebep olur. Bu sırada gerçekleşen durumlar maddeler halinde şu şekildedir:

Canlı hücrelerin doku oluşturmak için bir araya gelme süreci hem biyokimya hem de termodinamik tarafından yönlendirilmektedir. Gerçekleşen tüm tepkimeler termodinamik yasalarına göre şekillenir. Bir tepkime yalnızca termodinamik yasalara uygun ise gerçekleşebilir. Bu durum yalnızca biyolojik sistemler için değil tüm evrende de benzer şekilde çalışmaktadır. Dokular oluşurken bulundukları çevreye göre şekillenmektedir. Mikro çevrede bulunan moleküller belli bir düzende veya düzensizlikte bulunur. Bu düzensizlik veya düzen en önemli fizik yasalarından birini belirler. Bunlar termodinamik yasalarıdır.
Maddeler halinde verilen durumlar, en son aşamada evrenin entropisinin artmasına neden olur dolayısıyla kendiliğinden gerçekleşir. Termodinamiğin 2. Yasasına göre evrende entropi yani düzensizlik sürekli artmalıdır. Bu durumlardan birini termodinamik açıdan inceleyecek olursak yan yana bulunan fosfatlar başlangıçta düzenlidir. Bağların kırılması sonucunda ayrılan fosfatlar düzensizliği arttırır. Yani entropi artar ve tepkimeler bu şekilde ilerler.
Bir diğer aşamada olan ADP ve fosfat grupları ortamda bulunan su tarafından kararlı hale gelmesi sırasında su molekülleri fosfat ve ADP ile bağ oluşturacaktır yani daha düzenli bir yapı meydana gelecektir. Evren düzensizlik istese de yine de bir düzen oluşmuştur, bu durum 2. Yasa ile çelişiyor görünebilir. Ancak, su moleküllerin oluşturduğu düzen büyük sistem düzensizliğin oluşmasına neden olur.
ATP molekülünün yüksek enerji açığa çıkarmasının ardında termodinamik yasalara uygunluğu vardır.
Termodinamik, enerjinin transferi, dönüşümü ve enerji ile ilgili sistemlerin özelliklerini inceleyen bir fizik alt dalıdır. Termodinamik yasaları, termodinamikte temel prensipleri ifade eden kurallardır ve 3 adettir.
Termodinamiğin Birinci Yasası (Enerji Korunumu İlkesi)
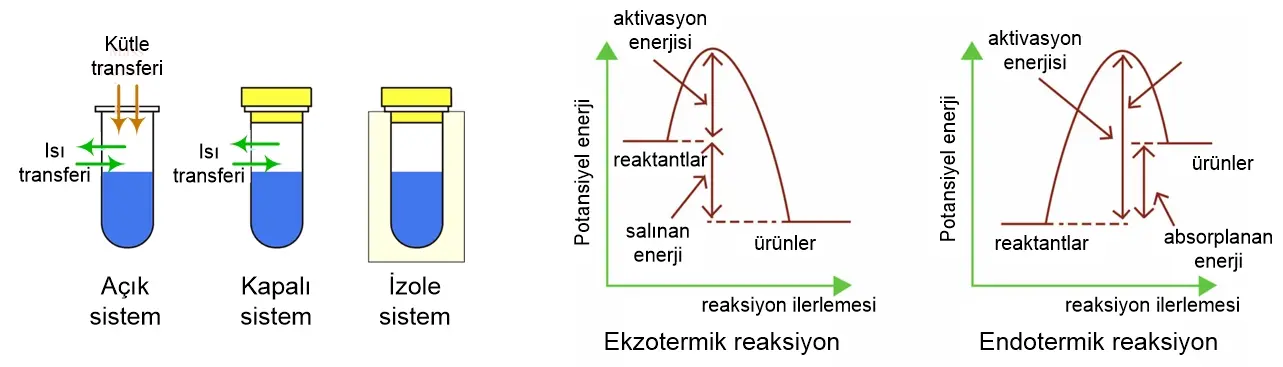
Birinci yasa enerjinin korunumu ilkesidir. Enerji vardan yok edilemez, yoktan ise var edilemez. Evrende bulunan bütün enerjiler sürekli korunur, enerji yalnızca form değiştirir. Örneğin var olan bir ısı enerjisi yok olmaz, mekanik veya ışık enerjisine dönüşebilir. Bir sistemdeki enerji artışı, sistem üzerine yapılan iş ve sistemle etkileşen ısı değişimlerinin toplamına eşittir.
Termodinamiğin İkinci Yasası
İkinci yasa, entropi kavramını yani moleküllerin düzensizliğini tanımlar ve “Evrende kendiliğinden gerçekleşen bütün süreçler evrenin entropisinde bir artışa yol açar (ΔS ≥ 0)” şeklindedir.
Bu yasa, ısı enerjisinin kendiliğinden sadece sıcak bir ortamdan soğuk bir ortama doğru akabileceğini belirtir. Ayrıca, bir sistemin entropisi (dağınıklığı) zaman içinde artar. Bu yasa, doğal süreçlerin düzensizlik ve entropi artışı eğiliminde olduğunu ifade eder. Entropi artıkça evrene verilen enerji artar. Bu yasa biyolojik sistemlerde de gerçekleşen her enerji aktarımı, evrenin entropisini arttırırken, iş yapabilecek faydalı enerji miktarını azaltmaktadır.
Termodinamiğin Üçüncü Yasası
Sıfır Kelvin (mutlak sıfır) sıcaklıkta bir kristalin entropisinin sıfır olduğunu ifade eden bu yasa, pratikte sıfır Kelvin'e ulaşmanın imkânsız olduğunu ifade eder. Bu yasa, sıcaklık sıfır Kelvin'e yaklaştıkça bir maddeye ait entropinin sıfıra yaklaştığını belirtir.
Bu yasalar, termodinamiğin temel taşlarını oluşturur ve enerjinin nasıl transfer edildiği, dönüştürüldüğü ve organizmanın çeşitli fiziksel sistemleri üzerindeki etkilerini anlamamıza yardımcı olur. Termodinamik yasalar enerji değişimleri ve tepkimelerin gerçekleşmesi ile doğrudan ilgilidir. Vücudumuzda gerçekleşen her türlü tepkime bu yasalara göre düzenlenir ve enerji türü olarak “Gibbs Serbest Enerjisi” kullanılır.
Hücrelerde kullanılan enerji “Gibbs serbest enerjisidir.” G ile tanımlanmaktadır. Hücrelerde gerçekleşen enerji değişimleri ve tepkimeler serbest enerji kavramı ile açıklanmaktadır. Gibbs serbest enerjisi, biyolojik sistemde yapılan maksimum iş olarak değerlendirilen termodinamik potansiyel enerji olarak tanımlanır. Yani, canlı sistemlerde bulunan serbest enerji termodinamik kurallara uyarlanmıştır. 1873’te Josiah Willard Gibbs makalesinde (Graphical Methods in the Thermodynamics of Fluids) ünlü matematiksel denklemini yayımlamıştır. Denklem şu şekildedir:
ΔG=ΔH–TΔS
Denklemde kullanılan kısaltmalar: ΔG, Gibbs serbest enerji değişimi
ΔH, Entalpi değişimi
T, Sıcaklık
ΔS, Entropi
Denklemde kullanılan kavramlar termodinamik konusu içinde kapsamlı şekilde anlatılmaktadır. Ancak, basitçe tanımlarsak:
Entropi: Evrenin hem makro hem de mikroskobik düzeydeki düzensizliğinin bir ölçüsüdür. Eriyen bir buz, entropiye mükemmel bir örnektir. Buz gibi katı moleküller oldukça sabit ve düzenlidir. Buz eridikçe moleküller serbestçe hareket edebilir hale gelir ve dolayısıyla düzensiz hale gelir. Su daha sonra gaz haline gelmek üzere ısıtıldıkça, moleküller havada bağımsız olarak hareket etme özgürlüğüne sahip olur. Buz içerisindeki H2O molekülleri oldukça düzenliyken eridikçe birbirlerinden uzaklaşır ve düzensiz hale gelir. Böylece, düzensizlik yani entropi artar.
Entalpi: Entalpi, enerji dönüşüm süreci sırasında enerjideki değişim miktarını tanımlayan bir terimdir. Direkt olarak gözlenemez ancak değişim miktarı hesaplanmaktadır. Entalpi iç enerji ile basınç çarpı hacmin toplamıdır. Genel anlamda sistemdeki ısının miktarı olarak düşünülebilir. Moleküllerin içerdiği bağ sayısı ve bağların kinetik enerjisi entalpi ile ilişkilidir.
Bir oda içerisinde bulunan topları düşünün, bu toplar ne kadar çok etrafa dağılırsa düzensizlik yani entropi artar. Bu bağlamda entropi biraz daha gözlemlenebilir; ancak entalpi ise daha çok maddelerin iç enerjisi ile alakalıdır, bu yüzden direkt olarak tespit etmek zordur. Su sıvı halden buz haline geçerken hidrojen bağları arasındaki değişimler entalpi enerjisi ile gerçekleşir.
Toplam entalpi ve entropi değişimleri ile serbest enerji hesaplanabilir. Hesaplanan değerlerle birlikte kimyasal bir tepkimenin “ekzergonik” dışarıya enerji veren ya da “endergonik” dışarıdan enerji alan olduğu belirlenebilir.
Gibbs serbest enerjisi ile bir tepkimenin ekzergonik ya da endergonik olmasına göre kendiliğinden gerçekleşip gerçekleşmeyeceği tespit edilebilir ve kimyasal tepkimeler için kullanılabilir. Gibss enerjisi negatif ise tepkime yüksek enerjili ve kendiliğinden gerçekleşir. Tam tersi, Gibss enerjisi pozitif ve sıfıra yakın değerde ise tepkime kendiliğinden gerçekleşmez. Serbest enerji formülü ile sıcaklığın ve basıncın sabit olduğu hücrelerimizde gerçekleşen tepkimenin yönü, kimyasal denge noktası ve ne kadar ürün oluşacağı tahmin edilebilir.
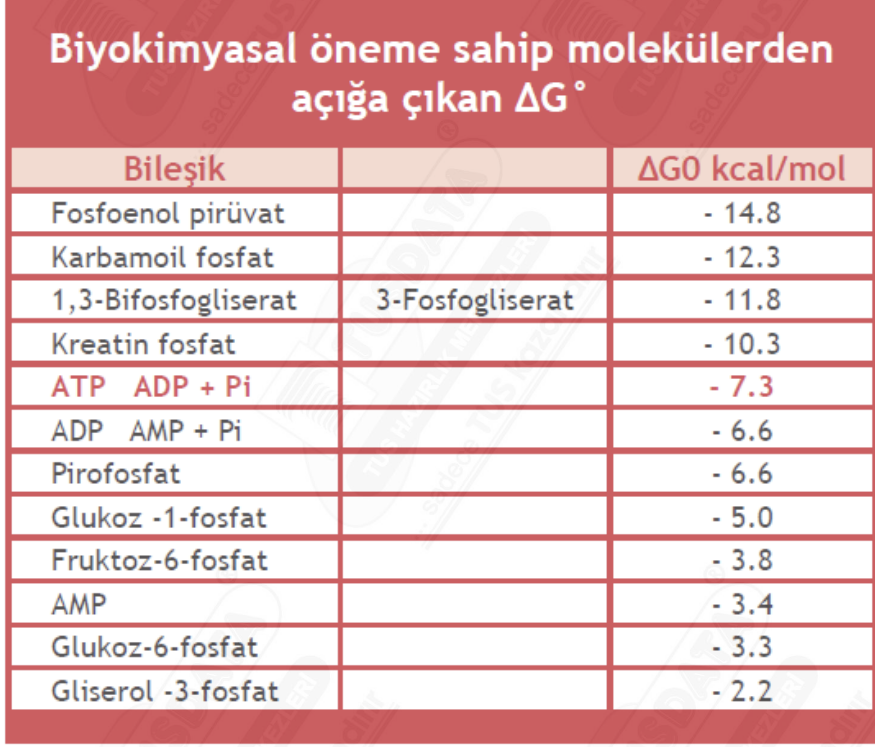
İnsanlar, serbest enerjiyi tükettikleri besinlerden, bitkiler ise güneş ışığından elde eder. Elde edilen serbest enerji ATP veya fosfoenol pirüvat, kreatin fosfat gibi yüksek enerjili bileşiklere dönüştürülür. Bu bileşikler arasında en yüksek enerji fosfoenol pirüvatta bulunur.
Fosfoenol pirüvat neredeyse ATP molekülünden 2 kat daha fazla enerji verebiliyorken, neden hücrelerimiz ATP molekülünü tercih eder? Hücrelerimiz en verimli şekilde çalışmaya programlanmıştır. Eğer her seferinde çok fazla enerji ortaya çıksaydı bu enerjinin dağıtılması ve kontrol edilmesi zor olurdu. Ayrıca her tepkime yüksek enerji gerektirmez. ATP ise ara değerde bir enerji sağlar ve ideal şekilde çalışır. ATP yokluğunda diğer moleküller kullanılır. Bazı tepkimelerde ise ATP yerine GTP molekülü kullanılır. Neden GTP molekülünün kullanıldığı sorusu henüz yanıt bulamamıştır.